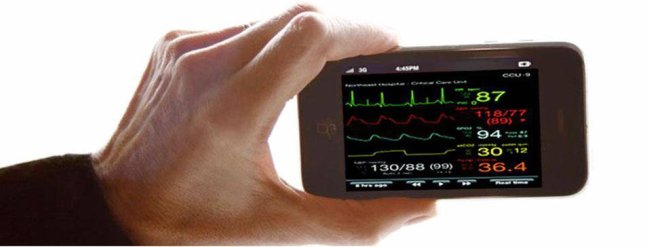
En este proceso de transformación del sistema sanitario (llámalo eSalud o llámalo x) una parte importante la están jugando los teléfonos móviles de última generación o smartphone que nos permiten monitorizar todas nuestras constantes vitales y facilitan el registro de valores de interés. Hay aplicaciones móviles que nos permiten desde controlar nuestro ritmo cardíaco a manejar niveles de glucosa. Y así hasta las más de 7000 aplicaciones para iPhone relacionadas con el mundo de la Salud estimadas por MobiHealthNews. La creciente popularidad de dispositivos tipo tablet como el iPad hará crecer este mercado sin duda.
Llegados a este punto conviene recordar que cualquier persona con unos conocimientos básicos de programación puede crear una aplicación para móviles. En el caso del iPhone y del AppStore de Apple, son los propios desarrolladores los responsables de lo que crean. De tal modo que cuando instalas una de estas aplicaciones en tu smartphone (o tablet) ¿estás convirtiéndolo en un dispositivo médico? ¿debería estar sometido a regulación sanitaria?
Es bien conocido el caso estadounidense donde la FDA es la encargada de dar el visto bueno a todos los fármacos y dispositivos sanitarios que pueden comercializarse en su territorio. Además según la legislación de los Estados Unidos la definición de "dispositivo sanitario" es extremadamente amplia y va desde los depresores de lengua o los orinales hasta los complejos marcapasos implantables con microchips de última generación o sistemas de Resonancia Magnética Nuclear. El sistema español es similar ya que la Agencia Española de Medicamentos y Productos Sanitarios es la encargada de su regulación y siguiendo sus directrices, hablamos de producto sanitario cuando nos referimos a:
"cualquier instrumento, dispositivo, equipo, material u otro artículo, utilizado solo o en combinación, incluidos los programas informáticos que intervengan en su buen funcionamiento, destinado por el fabricante a ser utilizado en seres humanos con fines de:
Diagnóstico, prevención, control, tratamiento o alivio de una enfermedad.
Diagnóstico, control, tratamiento, alivio o compensación de una lesión o de una deficiencia.
Investigación, sustitución o modificación de la anatomía o de un proceso fisiológico.
Regulación de la concepción.
Y que no ejerza la acción principal que se desee obtener en el interior o en la superficie del cuerpo humano por medios farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales medios." #
Tanto aquí como en los Estados Unidos el problema parece pues depender de las posibles interpretaciones que se hagan de la legislación y aunque no existen precedentes judiciales en el caso de las aplicaciones sanitarias para teléfonos móviles, el hecho de que el Real Decreto que debe regularlas ya esté obsoleto aunque date de 2009 deja en evidencia el largo camino por recorrer en este sentido. El problema de la regulación tiene importantes implicaciones en la innovación en esta área.
Mientras los organismos públicos no se ponen a trabajar en ello, en diciembre de 2010 la mHealth Regulatory Coalition dio a conocer un libro blanco con interesantes reflexiones. Los planteamientos de los autores van desde la necesidad (o no) de regular tanto los programas como los dispositivos móviles, hasta la clasificación que podría utilizarse en caso de hacerlo. No hay respuestas claras, pero sí han sabido lanzar unas cuantas preguntas clave que necesitan respuesta para que la mHealth siga avanzando con todas las de la ley.
Los autores identifican tres grandes lagunas:
1. Intencionalidad de uso ¿Hasta qué punto quedarán exentos de regulación los productos relacionados con la salud móvil mientras enfoquen sus campañas hacia el bienestar del ciudadano en contraposición a su uso como herramientas para el manejo e incluso diagnóstico de determinadas patologías?
2. Accesorios conectados y configuración de componentes ¿Hasta qué punto deben de ser regulados los teléfonos móviles y otros dispositivos de comunicación por el simple hecho de estar especialmente preparados para conectarse a productos sanitarios?
3. Función del software ¿Hasta qué punto son reguladas y regulables las aplicaciones diseñadas para ser instaladas en teléfonos móviles, ordenadores personales, servidores o en la nube, si su función es la de crear lazos comunicativos entre el dispositivo y algún producto sanitario o servir como repositorios de datos sanitarios?
Un documento de 54 páginas en el que quedan identificados los temas clave para la discusión.
Resulta complicado imaginar un contexto en el que las agencias reguladoras (FDA, AEMPS...) puedan manejar el creciente volumen de trabajo y además controlar este tipo de dispositivos y aplicaciones. Sería además complicado el escenario en el que una empresa farmacéutica crease una aplicación para comunicación directa con los pacientes ¿deberían revisarse todas la comunicaciones? ¿debería darse el visto bueno a la aplicación?
Será interesante cómo va evolucionando este tema a lo largo de los años, ¿qué pensáis?








Somos Medicina
Hoy he aprendido que...